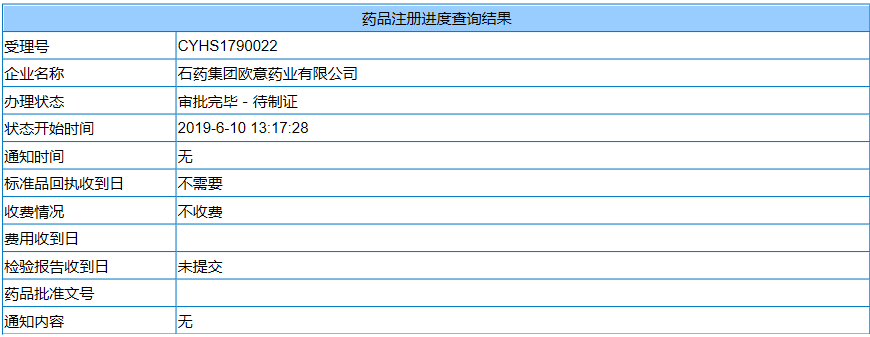
6月10日,石药集团「替格瑞洛片」的国内上市申请(CYHS1790022)获得国家药品监督管理局(NMPA)批准,成为该品种第2家获批上市的国内企业。
替格瑞洛是一种直接作用、可逆结合的P2Y12血小板抑制剂,属于新型抗血小板药物,相比氯吡格雷不需要经过肝脏代谢激活,具有更快速、更强效抑制血小板的特点,用于急性冠脉综合征(不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死)患者,包括接受药物治疗和PCI治疗的患者,降低血栓性心血管事件的发生率。
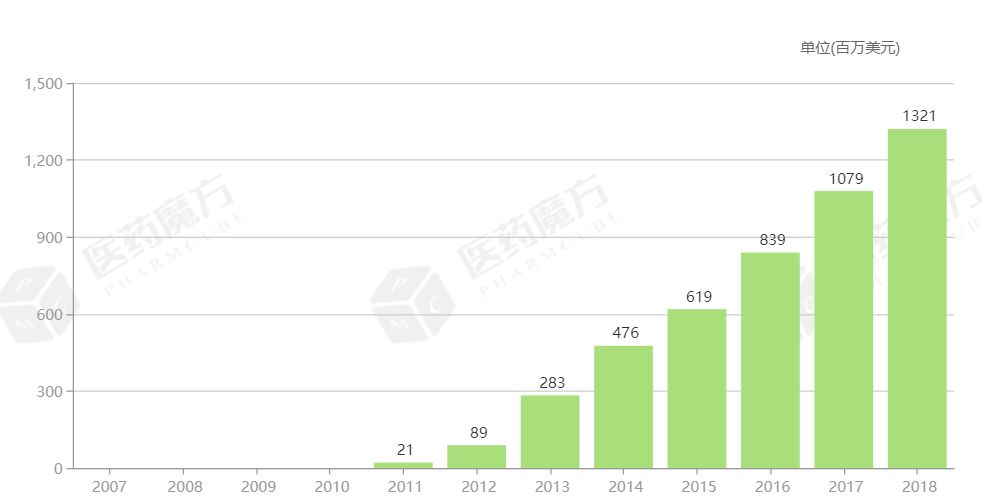
替格瑞洛原研药由阿斯利康研发,2010\/12\/2率先获得欧盟批准上市,2011\/7\/20获得FDA批准上市,2012\/11\/22在中国批准上市,商品名为倍林达。2017年,替格瑞洛通过谈判的方式进入国家医保目录,医保支付标准8.45元\/片(90mg)。2018年,阿斯利康替格瑞洛的全球销售收入达到13.21亿美元。
信立泰在2018年初成功挑战了替格瑞洛在中国的专利保护,在2018年8月公布获得替格瑞洛片的注册批件,成为了替格瑞洛的首仿厂家。石药集团的硫酸氢氯吡格雷片在6月4日刚刚按新4类获批上市,如今替格瑞洛片也按照新4类获批上市,成为信立泰之后第2家同时赢得氯吡格雷、替格瑞洛两大抗血栓品种一致性评价的国内企业。国内抗血栓药物市场格局将发生变化。
除了上述企业之外,还有包括正大天晴、扬子江药业、海正药业等在内的15家企业开发替格瑞洛,均按照新4类提交上市申请。其中东阳光药业的上市申请于2月3日被纳入优先审评,理由是“同一生产线生产,申请国内上市的仿制药”。海正药业在去年10月曾公告称替格瑞洛片的美国ANDA已获得FDA的暂定批准。







